痛みの神経生理学(3) 目次
【調整・認知)】 本来備わっている「痛みを抑える働き」について神経生理学的に理解することが今回のテーマ
■下行性疼痛抑制系の神経生理学的メカニズムについて
・興奮について(復習)
・抑制について
・「興奮性シナプス伝達」と「抑制性シナプス伝達」
■2種類の下行性疼痛抑制系について
・セロトニン系
・ノルアドレナリン系
■どうすれば下行性疼痛抑制系が活性化するのか?
・活性化させる2つの要因
・脳報酬系(ドーパミンオピオイドシステム)
・2種類のドーパミン発火
■ドーパミンシステムを破綻させる原因
・「サニーブレイン」と「レイニーブレイン」
・扁桃体の過剰興奮
・前頭前野の機能低下による慢性疼痛
・恐怖条件付けによる「痛覚」と「苦痛」
■様々な鎮痛作用
・好きなことをすることによる鎮痛
・期待することによる鎮痛
・考え方を変えることによる鎮痛
・不安をなくすことによる鎮痛
・運動(エクササイズ)による鎮痛
下行性疼痛抑制系の神経生理学的メカニズムについて
第3回目講座では「下行性疼痛抑制系による鎮痛のメカニズム」「なぜ慢性疼痛では下行性疼痛抑制系が機能低下を起こすのか?」「どうすれば下行性疼痛抑制系を活性化することができるのか」を説明していきます」。
1969年、ReynoldsがマウスのPAG(中脳中心灰白質)を電気刺激をすることで無痛開腹手術を成功させました。それ以降、脳の色々な部位を刺激することで鎮痛が起こるということがわかり、下行性疼痛抑制の研究が行われるようになりました。
興奮について(復習)
前回までの話では1次ニューロンから2次ニューロンへ興奮性神経伝達物質(グルタミン酸・サブスタンスP)が放出されることで活動電位が発生し、軸索を伝わることを学びました。
「興奮性シナプス伝達」
1次ニューロンの神経終末に活動電位が伝わると、電位依存性カルシウムイオンチャネルが開口し、Aδ神経線維からはグルタミン酸、C繊維からはグルタミン酸とサブスタンスPがシナプス間に放出されます。
2次ニューロンではグルタミン酸がAMPA受容体、サブスタンスPがNK-1受容体に結合します。
AMPA受容体はイオンチャネル型なので、グルタミン酸が受容体に結合すると陽イオン(Na⁺)が細胞内に流入して、膜電位が上昇します。NK-1受容体はGたんぱく質共役型なので、サブスタンスPが結合すると生化学反応が起き、リン酸化酵素である「キナーゼ」が産生されます。
その過程でNMDA受容体がリン酸化され、Mg⁺⁺(マグネシウムイオン)の結合が取れて、イオンチャネルが開口しやすくなり、グルタミン酸が結合することで細胞内に陽イオン(Ca⁺⁺)が流入して、膜電位が上昇し、閾値に達すると電位依存性Naイオンチャネルが開口し、Na⁺が細胞内に流入し、細胞は興奮します。
しかし、シナプス間は興奮性のみではなく、抑制系のニューロンもシナプスしています。下行性疼痛抑制系もその一つです。
「抑制性シナプス伝達」
抑制系について
抑制とはどういうことかと言いますと、興奮させないように(活動電位が起きないように)膜電位を下げることです。
方法は2つあります。
1つ目は細胞外に陽イオンを出すこと
K⁺イオンはイオンチャネルが開口すれば、濃度差による拡散で細胞外に流出します。よってK⁺イオンチャネルが開口すれば膜電位が下がり興奮しづらくなります。
2つ目は細胞内に陰イオン(Cl₋=塩化物イオン)を流入させること
陰イオンが流入することで、膜電位が下がり興奮しづらくなります。
シナプス間に「抑制性神経伝達物質」が放出され、膜電位が下がることで抑制作用が生じます。
抑制系の神経伝達物質と受容体
・セロトニン=5-HT1受容体
・ノルアドレナリン=α2受容体
・GABA=GABAa受容体・GABAb受容体
・オピオイド(βエンドルフィン・エンケファリン等)=μ(ミュー)受容体
※興奮・抑制両方(受容体により異なる)※のちほど説明します。
・セロトニン
・ノルアドレナリン
「興奮性シナプス伝達」と「抑制性シナプス伝達」について
1つのシナプス間では興奮のみの入力だけではなく、抑制性ニューロンの入力が繋がっています。
「病気がみえる・脳神経」
細胞内に陽イオン(Na⁺・Ca⁺⁺)が流入することで膜電位が閾値に近くなる=興奮しやすくなる
細胞内に陰イオン(Cl-)が流入することで膜電位が下がる=興奮しにくくなる
細胞外に陽イオン(K⁺)が流出することで膜電位が下がる=興奮しにくくなる
『多くの興奮・抑制性ニューロンがシナプスする』
興奮と抑制の総和
興奮性シナプスと抑制性シナプスの総和により、膜電位が閾値に達すれば活動電位が発生し興奮し、膜電位が閾値に達しなければ活動電位が発生しないので興奮されず、電気信号は抑制されて伝わりません。
①侵害刺激が加わり、脱分極を起こし起動電位が発生するが、単発の刺激では閾値には達成せず、活動電位は発生しない。次の侵害刺激が入る前に、ナトリウム・カリウムポンプとK⁺リークチャネルにより、静止状態に戻る。
②発生した起動電位が静止膜電位に戻る前に、次の刺激が加わることで閾値に達し、電位依存性Na⁺チャネルが開口することで細胞内にNa⁺が流入し、活動電位が発生し興奮する。
③それぞれの興奮性ニューロンから同時に刺激が加わると総和で閾値に達し興奮する。
④抑制系ニューロンから刺激が加わると膜電位が下がります。興奮性ニューロンと抑制系ニューロンの総和により、膜電位が閾値に達しなければ活動電位は発生せず、抑制されます。
2種類の下行性疼痛抑制系について
下行性疼痛抑制系には、縫線核から始まり、RVM(吻側延髄腹内側部)を経由してDH(後角)に下行するセロトニン系とLC(青斑核)から始まり、DLPT(背外側橋中脳被蓋)を経由して後角に下行するノルアドレナリン系があります。
★セロトニン系(3種類の抑制方法があります)
セロトニン作動性ニューロンによる抑制には3種類の方法があります。
① セロトニン作動性ニューロンによるもの
② GABA介在ニューロンによるもの
③ ENK(エンケファリン)介在ニューロンによるものです。
「作動性ニューロン」とは細胞内で神経伝達物質が産生されて、神経終末で産生された神経伝達物質が放出されるニューロンということです。
①セロトニン作動性ニューロンによる鎮痛
「痛みの考え方 丸山一男著」
脊髄後角における抑制性のセロトニン受容体は「5-HT1受容体」です。2次ニューロンにある抑制性Gたんぱく質共役型受容体(5-HT1)にセロトニンが結合することにより、生化学反応が起き、K⁺チャネルのリン酸化能力が低下し、K⁺チャネルが開口しやすくなります。よって拡散作用により、陽イオンであるK⁺が細胞外に流出して細胞膜の電位が下がり(過分極)、活動電位が発生されない(閾値に達しない)ので抑制されます。
ちなみにセロトニンは発痛物質でもあるので、末梢神経終末の細胞膜には「5-HT3受容体」が多く存在し、セロトニンがイオンチャネル型受容体である5-HT3受容体に結合すると、細胞内にNa⁺、Ca⁺⁺の陽イオンが細胞内に流入し、膜電位を上昇させることで興奮しやすくします。
神経伝達物質が同じでも受容体が異なることで興奮性の神経伝達物質にもなりますし、抑制系の神経伝達物質にもなります。
➁GABA介在ニューロンによる鎮痛
GABAは抑制性神経伝達物質なので、シナプス間にGABAが放出されると抑制されます。そのメカニズムはまず、GABA介在ニューロンを興奮させて末梢からGABAを放出させないといけないので、その興奮性神経伝達物質は「セロトニン」になります。興奮性なので受容体は「5-HT3受容体」になります。
脊髄後角において、2次ニューロンの細胞膜にあるGABAa受容体にBAGAが結合すると、イオンチャネル型受容体であるGABAa受容体はチャネルが開口することで、細胞内にCl-(塩化物イオン)が流入し、膜電位が下がることで鎮痛作用が生じます。
またシナプス前膜にあるGABAb受容体(Gたんぱく質共役型受容体)にGABAが結合すると生化学反応により、K⁺チャネルが開口し膜電位を下げます。
③ ENK(エンケファリン)介在ニューロンによる鎮痛
GABA同様にENK(エンケファリン)作動性ニューロンもまた抑制性ニューロンで、セロトニンによる興奮により、シナプス間にエンケファリンを放出させることで、膜電位を下げる働きをする。受容体はMOP(μ受容体・δ受容体)です。
内因性神経伝達物質であるエンケファリンがシナプス間に放出され、2次ニューロンの細胞膜にあるμ受容体に結合することで、生化学反応が起きます。そしてリン酸化能力が低下することで、K+チャネルが開口し,拡散作用により、細胞外にK⁺が流出することで膜電位が下がり鎮痛が生じます。モルヒネやフェンタニルの薬物投与も同様の作用が生じます。
★ノルアドレナリン系(2種類の抑制方法があります)
ノルアドレナリン系には2種類の入力があります。1つはノルアドレナリンが受容体に結合することで鎮痛が生じるノルアドレナリン作動性ニューロン(受容体はα2受容体)とセロトニン作動性と同様にGABAによる鎮痛です。
①ノルアドレナリンによる鎮痛
ノルアドレナリンがα2受容体に結合すると、生化学反応が起き、リン酸化能力が低下することで、K⁺チャネルが開口しやすくなります。陽イオンであるK⁺が細胞外に流出することで膜電位が下がり鎮痛作用が起こります。
➁GABA介在ニューロンによる鎮痛
メカニズムはセロトニン系と同じで、GABA介在ニューロンを興奮させるためにノルアドレナリンがα1受容体に結合することで、細胞内に陽イオンであるNa⁺が流入し活動電位が生じます。
GABA介在ニューロンが興奮し、神経終末でGABAをシナプス間に放出することでGABAa受容体のイオンチャネルが開口し、陰イオンであるCl-(塩化物イオン)が細胞内に流入することで膜電位が下がり鎮痛が生じます。
シナプス後抑制とシナプス前抑制
「日本臓器製薬 痛みのしくみと歪み」
脊髄後角において下行性に鎮痛を作用させる場合、
①シナプス後膜である2次ニューロンを抑制させる「シナプス後抑制」
②1次ニューロンの神経終末に作用させる「シナプス前抑制」とがあります。
①「シナプス後抑制」は2次ニューロンで膜電位が閾値を超えて活動電位が発生すると興奮してしまうので、2次ニューロンで陽イオン流入による活動電位を起こさせないように、膜電位を下げることです。
②「シナプス前抑制」は1次ニューロン終末で興奮性神経伝達物質が放出されないように、1次ニューロン終末の電位依存性Ca⁺⁺チャネルを開口させないように膜電位を下げることです。
下行性疼痛抑制系を活性化させる要因
慢性疼痛は痛みを抑える働きが低下して、痛みを感じやすくなってしまっている状態と言えますが、ではどうすればこの働きがを活性化することができるのでしょうか?
先ほども説明したように下行性疼痛抑制系の研究の始まりはPAG(中脳中心灰白質)を電気刺激することで、PAG内のグルタミン酸作動性ニューロンが興奮し、その活動電位がセロトニン系であるRVM(延髄腹内側部)に伝わることで、脊髄後角にセロトニンを放出して、鎮痛作用を起こします。
「日本臓器製薬 痛みのしくみと歪み」
また上行性の痛覚信号は途中で、枝分かれし、RVMやPAGに興奮性の刺激を入力して、下行性疼痛抑制系の働きを高めます。よって下行性疼痛抑制系を活性化させる1つ目の要因はPAG,RVMへの興奮性の入力です。
しかし本来、急性の痛みは危険信号であり、すぐに痛みの部位や強さを認知しなくてはいけません。急性の痛みを強く抑制させてしまうと痛みに気づかず、さらなる損傷を招くかもしれません。そこで、疼痛と鎮痛のバランスを取る必要があります。
PAG(中脳中心灰白質)にはグルタミン酸作動性ニューロンだけでなく、GABA作動性ニューロン、ENK(エンケファリン)作動性ニューロンも含有しています。
そして通常はグルタミン酸作動性ニューロンはGABA作動性ニューロンにより抑制を受けています。
グルタミン酸(アミノ酸)ニューロンはGABAニューロンによって抑制を受けていることにより、RVMやLC(青斑核)への興奮性入力が減少し、セロトニンやノルアドレナリンの放出が低下するので、通常の痛みでは抑制があまり効きません。
そしてその後、緊急に鎮痛が必要になった場合、脳内からオピオイドが放出されます。
オピオイドは抑制性神経伝達物質なので、GABAニューロンを抑制し、抑制の抑制をすることで(脱抑制)PAG内のグルタミン酸作動性ニューロンが興奮しやすくなり、下行性疼痛抑制系の働きが高まり後角において鎮痛作用を起こします。
よって下行性疼痛抑制系を活性化させる2つ目の要因はオピオイドの分泌です。
このようにオピオイドの放出によって、抑制を受けていた下行性疼痛抑制系の働きが活性化します。逆に、慢性疼痛患者はオピオイドの放出が少ないが故に下行性疼痛抑制系の働きが低下していると言えます(第3回痛みのアプローチ復習)
脳報酬系(Mesolimbic system)
楽しいことをしている時、目的を達成した時、褒められた時、新しい行動をする時、好奇心が沸いている時、恋愛感情を感じているとき、美味しいものを食べている時など、心がワクワク・ドキドキして、期待感や高揚感、達成感を感じている時に脳内で活性化する神経回路があります。これを「脳報酬系」と呼びます。
「Mesolimbic system」
脳報酬系は快情動の回路=mesolimbic system(中脳辺縁系)とも呼ばれ、中脳の腹側被蓋野(VTA)に刺激が加わると、ドーパミン(DA)が放出され、側坐核(NAc)のDA受容体(D2受容体)に結合されると、側坐核からDAとそれに伴い、オピオイドも分泌され、脳内にあるオピオイド受容体が活性化します。
ドーパミン研究のきっかけはマウスの腹側被蓋野(VTA)に電極を取り付けて、設置したレバーをマウスが押すことでVTAを刺激するようにしたところ、1時間に何千回もレバーを押し続けました。これはVTAを刺激することで、脳報酬(mesolimbic system)が活性化され、ドーパミンが分泌されたことで、さらに快楽を求めて行動した結果によるもの考えられます。
脳報酬系と痛みを感じた時の脳活動が同じだった!!
報酬を受けることでVTAが活性化し、ドーパミンが放出されることで側坐核も活性化します。
その後、中脳辺縁系(A10神経)は扁桃体(Amyg)・前頭前野(PFC)・前帯状回(ACC)などに興奮が伝わります。
そして近年f-MRIなどの脳画像解析により、この脳報酬系(mesolimbic system)は報酬を得た時に限らず、急性の痛みや急性のストレスを受けた時にも同じ脳部位(VTA・NAc・Amyg・PFC)が活性化することが分かってきました。
ドーパミン・オピオイドシステムによる鎮痛
ドキドキ・ワクワクした時、または急な痛みを感じた時、VTA(腹側被蓋野)が活性化し、VTA内のドーパミン作動性ニューロンからドーパミンが放出されます。
そして、NAc(側坐核)のDA受容体に結合することで、NAcが興奮し、ドーパミンとともにオピオイドを脳内に分泌します。このオピオイドがPAG(中脳中心灰白質)に結合することで、下行性疼痛抑制系が賦活し、脊髄後角にて痛みの抑制機能が働くことになります。
逆に慢性疼痛患者はこの「脳報酬系」「mesolimbic system」「ドーパミン・オピオイドシステム」が機能低下している可能性があります。
その原因はドーパミンの不足に伴う「側坐核」の機能低下によります。側坐核が活性化しないとオピオイドシステムも活性化されず、下行性疼痛抑制系が活性化しないからです。
ドーパミンがVTA/NAcから分泌されることで、それをきっかっけに脳内のオピオイド受容体が活性化します。
オピオイド分泌に関連する部位は、PAG(中脳中心灰白質)・PFC(前頭前野)・ACC(前部帯状回)・Amyg(扁桃体)・Insula(島)です。
好きなことをすることによる鎮痛機序
何か好きなことに集中している時や楽しい時は痛みを「忘れている」と仰る患者さんもおられます。また経験的にも気分が良い時は痛みを感じにくいこともあります。
このメカニズムは「快の情動」により脳報酬系が活性化し、VTAからNAc(側坐核)にドーパミンが放出されることでドーパミン・オピオイドシステムが活性化します。
そしてPAG(中脳中心灰白質)において下行性疼痛抑制系が賦活し、痛みを抑える働きが高まった結果と言えます。
しかしすべての慢性疼痛患者が楽しいことをすれば痛みが無くなるとは限りません。なぜならいくら楽しいことをしても「脳報酬系」「sesolimbic system」が働かない場合もあるのです。このシステムのメインはVTA→NAcですが、ドーパミンの分泌が低下すると機能低下に陥ります。ドーパミン分泌の調節には様々な部位からの興奮・抑制が行われるのです。
◆2種類のドーパミン発火(tonic/phasic)
ドーパミンが分泌されれば、気分も良くなり、痛みも感じにくくなりますので、ドーパミンを出すことは大切ですが、興奮と抑制のバランスが取れず、ドーパミンが過剰に分泌されてしまうと、興奮しやすくなったり、報酬を得たいがために依存症になってしまったり、病的になると統合失調症になってしまう可能性があります。
逆に、ドーパミンが少なくなってしまうと、慢性疼痛やうつ傾向になってしまったり、記憶力低下、病的になると、パーキンソン病に繋がってしまいます。
そこで脳内では過剰・抑制されすぎないように互いに拮抗し合って神経伝達物質の放出をコントロールしているのです。ドーパミン作動性ニューロンがあるVTAには2種類の異なったドーパミン発火があります。
1つはTonic(トニック)DAと呼ばれるもので、外部の刺激に関係なく、つねに持続的に少量のドーパミンを放出しています。
もう1つはPhasic(フェージック)DAと呼ばれるもので、こちらは外部からの刺激により活性化され、シナプス間まで大量のドーパミンを放出します。これによりドーパミン・オピオイドシステムが機能して鎮痛作用が生じます。
そしてこのトニックDAとフェージックDAは拮抗的に働いており、どちらかが優位になるともう片方は抑制される仕組みがあります。つまり、慢性疼痛患者は主にトニックDAが優位になってしまい、ドーパミン・オピオイドシステムが働かなくなってしまっていることが考えられます。
ではどのように2つのDAニューロンは制御されているかと言いますと、
まず淡蒼球(VP)に内在する抑制性ニューロンであるGABA作動性ニューロンが興奮することにより、トニックDAニューロンを抑制させるので、相対的にフェージックDAニューロンが優位な状態になっています。この状態であれば、外部からの刺激があった際にすぐにドーパミンが放出され、「快情動」や「鎮痛」へと働きます。
よって淡蒼球がつねに活性化されている状態であれば良いのですが、慢性的なストレスや慢性痛により、海馬(HP)や扁桃体(Amyg)の興奮性のグルタミン酸作動性のニューロンが活性化されることにより、側坐核にあるGABAニューロンが興奮し、淡蒼球のGABAニューロンを抑制します。
つまり淡蒼球の抑制性であるGABAニューロンが抑制されるので、トニックDAニューロンを抑制できなくなり、トニックDAニューロンが優位になります。トニックDAニューロンのドーパミン放出は少ないので、ドーパミン・オピオイドシステムは働かなくなり、痛みを感じやすくなってしまうのです。
まとめると扁桃体・海馬による過剰興奮により、側坐核のGABAニューロンが興奮し、淡蒼球の働きを低下させ、フェージックDAからトニックDAに切り替わることで、ドーパミンの放出も少なくなり、側坐核のDA作動性ニューロンの機能低下によりドーパミン・オピオイドシステムが機能しない状態になってしまうのです。
ドーパミンオピオイドシステムを破綻させる原因
「サニーブレイン」・「レイニーブレイン」という用語はオックスフォード大学教授エレーヌ・フォックスが作った言葉ですが、サニーブレイン(楽観脳)とはポジティブな心の働きであり、側坐核が活性化している状態で、物事の明るい所に目が行きやすくなります(安心・楽しい・うれしい・幸せ)
レイニーブレイン(悲観脳)とはネガティブな心の働きであり、扁桃体が活性化している状態で、暗い所に目が行ってしまう(不安・心配・恐怖・憂鬱)
慢性疼痛の状態では、側坐核の機能低下は物事の明るい所に目が行きにくくなり、扁桃体の過剰興奮はより一層暗い所に目が行きやすいくなります。
これが慢性疼痛の特徴的な「脳内活動パターン」なのです。
これを踏まえて痛みの悪循環モデル(痛みが慢性化するプロセスを説明した図)を見てみますと、
痛みを体験したときに「患者さんご自身がどういう『痛みのミカタ』をしているのか」が重要になってきます。そしてこれが先ほどの「脳内活動パターン」に影響を受けています。
痛みを感じた時に側坐核の機能が働きポジティブな心の働きの場合、不安や恐怖を感じずに、安心して痛みと向き合うことで時間の経過とともに改善していく事でしょう。
しかし、側坐核の働きが低下し、また扁桃体の機能が亢進すると、ネガティブな心の働きが強くなり、「痛みの破局化」が生じやすくなります。
痛みの破局化により「常に痛みが気になる」「だんだんと悪くなっている」「自分では何もできない」と思い込み、結果、恐怖や不安が強くなり、それに伴い身体を動かすことも少なくなり(不動)、筋肉の緊張、筋力の低下・気分障害(鬱傾向)が生じ、より痛みが強くなり慢性化するプロセスとなります。

この痛みの破局化が生じる原因は「間違った痛みのミカタ」なのです。ミカタを変えることで不安から安心へ、そして行動が変わることで結果も変わります。これは痛みだけでなく、物事の明るい所に目が行くようになり、人生が好転するのです。
扁桃体の過剰興奮による影響
扁桃体が過剰興奮することで様々な脳部位の機能低下を招くことにより、ドーパミン・オピオイドシステムが正常に機能しなくなることで、下行性疼痛抑制系の働きが低下し痛みを感じやすい状態となります。
痛みが扁桃体に入力されると扁桃体のグルタミン酸作動性ニューロンが側坐核のGABAニューロンへ投射されます(図④)それを受けて、側坐核のGABAニューロンが活性化され、GABA作動性ニューロンは淡蒼球(VP)に投射します。淡蒼球はVTAのトニックDAを抑制し、相対的にフェージックDAに切り替え、ドーパミンが放出しやすい状態にしておく働きがありますが、側坐核からのGABAによる抑制で、淡蒼球の働きも抑制され、トニックDAに戻るためVTAからのドーパミン放出も低下し、結果として、側坐核のドーパミンによる活動が低下します(図③)
痛いなどの【不快刺激】は側坐核のGABAニューロンへ刺激を入力しますが、イタ気持ちいいなどの【快刺激】は、側坐核のグルタミン酸ニューロンを活性化させ、側坐核の機能を高めます。またGABAニューロンへの刺激が無くなるため、淡蒼球(VP)への抑制も無くなり、VPによりトニック状態を抑制し、相対的にフェージック状態にすることで、VTAも活性化し、側坐核・前頭前野にドーパミンを放出し、ドーパミン・オピオイドシステムを活性化させます。
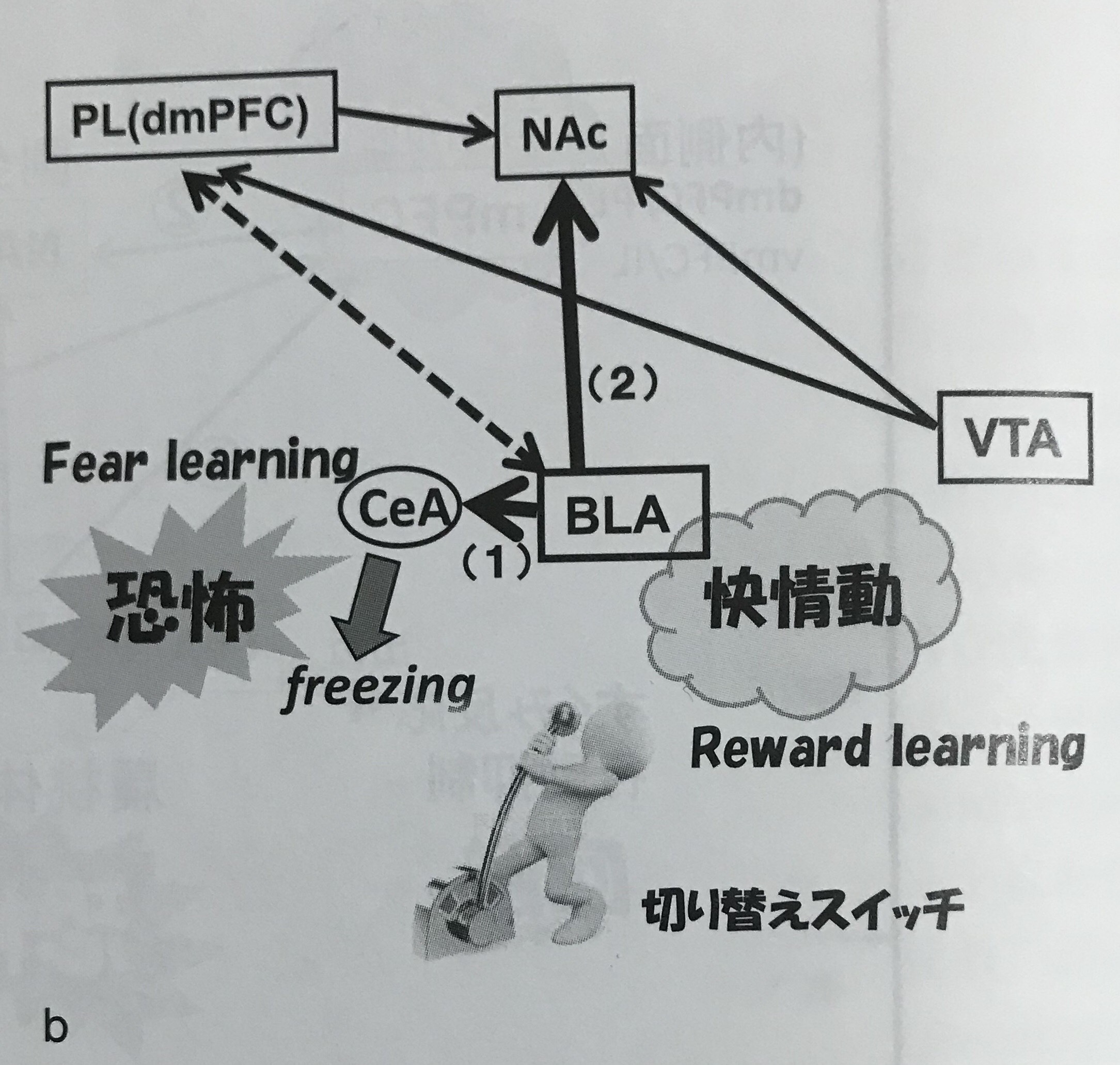
このように扁桃体は「快」「不快」を分ける切り替えスイッチのような働きをしています。
扁桃体が過剰興奮を起こすとグルタミン酸作動性ニューロンが内側前頭前野のGABAニューロンを興奮させ、内側前頭前野の機能を低下させます。
本来であれば、内側前頭前野から側坐核に興奮性の投射があり、側坐核が活性化することで鎮痛作用が起きます。
しかし扁桃体が過剰興奮を起こすことで内側前頭前野の働きが低下することで(GABAニューロンは活性化しているので内側前頭前野のGABAニューロンに関しては過剰興奮を起こしていると言える)側坐核への興奮性の入力も低下するので鎮痛作用は生じにくくなります。
さらに前頭前野は外側と内側で機能的に分かれており、お互いに拮抗的な関係にあります。mPFCのGABAニューロンの 過剰興奮により拮抗的な関係のDLPFC(背外側前頭前野)が 相対的に機能低下を起こします。
DLPFC(背外側前頭前野)機能低下と慢性痛
思考・認知・記憶・意思決定を司る前頭前野の機能低下が慢性疼痛を引き起こす原因とも言われています。拮抗的に繋がりがある【外側前頭前野⇔内側前頭前野】【外側前頭前野⇔扁桃体】ですが、扁桃体・内側前野(mPFC)の過剰興奮により、背外側前頭前野(DLPFC)の働きが低下してしまいます。
DLPFCは直接PAGに神経線維を伸ばしているので、DLPFCが活性化すれば、下行性疼痛抑制系が活性化して鎮痛を引き起こします。ただし慢性疼痛特有の脳内活動パターンとしてDLPFCの機能低下があるので、痛みを抑えにくい状態と言えます。
前頭前野(PFC)を活性化することによる鎮痛機序
痛みに意識を集中させずに、痛みから意識をずらすことで痛みを抑制することができます。たとえば、短期記憶させながら計算をしてもらう(n-back課題)、色と漢字を見て文字を答えてもらう(ストループ課題)等、このような課題をこなしてもらっているときに痛み刺激を加えると、痛みのレベルが下がります。
さらに認知課題のパフォーマンスが高い(集中している)と痛みの軽減も大きくなります。
この「集中(注意)による鎮痛」のメカニズムは背外側前頭前野(DLPFC)の活性化に伴うトップダウンでのPAG(中脳中心灰白質)への興奮性の刺激が下行性疼痛抑制系を賦活させたことと、DLPFCが側坐核の活動を促進させ、扁桃体の活動を抑制したことによって生じたと考えられます。
期待することによる鎮痛機序
ただの生理食塩水でも「期待」や「予測」とともに体内に入ると脳内からドーパミン・オピオイドが分泌されることにより、下行性疼痛抑制系が賦活され鎮痛が起きます。これをプラシーボ鎮痛といいます。
被験者の咬筋に高張食塩水を少量ずつ流入し、痛みの強さが一定値を保つように調整してから、被験者の静脈に0.9%の生理食塩水をゆっくり15mLをゆっくり15秒かけて注入し、それを4分ごとに繰り返す。
被験者には「研究中の薬の鎮痛効果を検定するために静脈へ注入する」と説明します。
被験者は「クスリ」と称したただの生理食塩水が注入されるたびに音声で15秒間にわたりそれを告げられる。
すると、脳内ではドーパミン、オピオイドが分泌されたのです。
そしてドーパミンの活性が大きいほど、オピオイドの活性も大きくなりました。
さらに被験者に「クスリ」の効果にどれくらい期待するかを数値で示すように求めると、数値が高い程(期待が大きい程)、側坐核におけるドーパミン・オピオイドの活性が高かった。
【ただの生理食塩水】が脳内にオピオイドを分泌させ、鎮痛を起こしたのは『この薬は効くかもしれない』『きっと効くだろう』という期待や予測だけです。その結果として、脳報酬系が賦活され、ドーパミン・オピオイドシステムが働き、鎮痛が起こったと考えられます。プラシーボ鎮痛は「偽薬」に限らず、治療者の態度や言葉、場の雰囲気にも影響されます。
プラシーボ鎮痛は前頭前野での認知・思考が必要なので、アルツハイマー病・認知症などのように前頭前野に神経変性がある場合は起こりません。
学習や認知機能、「静脈に注射する意味」などの認識ができない場合は鎮痛作用は起きないのです。よって、期待や希望的予測がなければプラシーボは起きないのです。
しかし、「期待」や「希望」、「報酬」により脳報酬系回路が働けば、ドーパミン・オピオイドシステムが下行性疼痛抑制系を賦活し痛みを抑制してくれるのです。
恐怖条件付けによる「痛覚」と「苦痛」
予期せぬことで急性の痛みを感じた時、痛いという感覚だけでなく、痛みに対して「不安・恐怖」を感じ、その状況を記憶することで、再びそのような状況にならないように対応するわけですが、本来であれば、その恐怖記憶は一時的なもので時間が経てば忘れていきます(消去されます)
しかし、興奮性の入力が過剰に多かったり、繰り返された場合、その恐怖記憶は条件付けされます。さらに記憶を消去させる働きが低下するとつねに恐怖条件付けが続くことになります。
臨床的には腰痛経験がまったく無い人が前屈をしても無痛ですが、たまたま荷物を取ろうと前屈した際に「ギクッ!!」と損傷性のぎっくり腰になったとします。通常であれば、損傷も2週間程度で治り、快方に向かうはずですが、痛み(痛覚)を感じた際に、「歩けなくなったらどうしよう」「骨に異常があるのでは?」と恐怖や不安を感じたり、病院を受診した際に先生に「大きいヘルニアがありますね。もしかしたら手術が必要かもしれません」などと脅迫的説明を受けたことにより、より痛みが強く感じるかもしれません(苦痛)
そして、腰の損傷が治ってからも腰を曲げるという動作が不安になり、前屈の動作をしなくなります。そして筋肉も硬くなり、痛みの悪循環から抜け出せなくなります。
内側前頭前野(mPFC)による条件付け
扁桃体に急性な刺激が加わると恐怖・すくみ反応が現れますが、内側前頭前野のdmPFC(PL)を化学物質により不活性化させておくと、刺激を加えても恐怖・すくみ反応は出ません。よって、恐怖・すくみ反応を起こすには、dmPFC(PL)の活性化が必要になります。
また有害刺激が加わっても、無害刺激を繰り返し受け続けると、条件付けされた恐怖・すくみ反応は起きなくなります。これを「恐怖条件付けの消去」と言いますが、この働きはmPFCのvmPF C(IL)の興奮性の入力が扁桃体のITC(GABAニューロン)を興奮させ、中心核(CeA)の活動を抑制させるので恐怖・すくみ反応がおさまります。
しかし慢性疼痛の場合、内側前頭前野(vmPFC)は扁桃体により抑制されているので、この恐怖反応の消去の働きも抑制され、恐怖反応がなかなか取れないのです。
腕傍核から入力される侵害刺激による「痛覚」は時間とともに消失していきますが、視床・辺縁系・前頭前野から入力される情動系の痛み「苦痛」はなかなか消えません。
一方、mPFCは恐怖条件付けだけでなく、報酬に対しての条件付け(記憶)にも関与しています。気持ちいいなどの快情動は内側前頭前野のdmPFC(PL)を興奮させ、側坐核へ興奮性の入力を起こします。
つまり「恐怖に対する条件付け」は扁桃体が関与し、「報酬に対する条件付け」は側坐核が関与し、そして、それらをコントロールしているのが内側前頭前野(mPFC)と言えます。
考え方を変えることによる鎮痛作用機序
情動的な刺激に対して「どのように意味づけするのか」によって脳内の神経回路の活動が変わります。たとえば、ネガティブな状況に対してポジティブに意味づけるということを求められると腹外側前頭前野(VLPFC)が活性化します。
VLPFCが側坐核に対して興奮性の神経伝達物質を放出して側坐核を活性化させ、それに反して、扁桃体に対しては抑制に働きます。
このような『ポジティブな再解釈』による鎮痛効果が明らかになってきました。
例えば、『与えられる痛み刺激を自分でボタンを押すことで止めることができる条件と他者やコンピューターによって止められる条件では自分で止められる条件では主観的な痛みのレベルが低く、腹外側前頭前野(VLPFC)の活動が優位に増大していた』
これは痛みという不快な刺激を「自分の力でコントロールできるもの」とポジティブに再解釈することにより、VLPFCが活性化し、脳報酬系である側坐核を賦活させて主観的な痛みが減少したものと思われます。
ある刺激に対して、ネガティブに解釈するように指示すると、不快感が増加し 、内側前頭前野(mPFC)や扁桃体(Amyg)の活性化が見られる。
これは薬の副作用があると思い込むことでネガティブな反応を起こす「ノーシーボ効果」 と呼ばれます。
このノーシーボ効果の際の脳領域を調べてみると、海馬、島、 前帯状回などの痛み関連領域が活性化し、DLPFCの活動の低下が見られた。
このことから痛みに対してのネガティブな思考が痛みの情動面に関連する領域の活動を増大させることがわかります。
また違う実験では、8日間の繰りかえされる痛み刺激に対して、「痛みの感覚は徐々に減少していく」と説明された群と「痛みの刺激が徐々に増加していく」と説明を受けた群では、「減少していく」と説明を受けた群ではVASの減少が見られたが、「増大していく」と説明を受けた群では、痛み関連領域である島皮質の活動が増加し、VASの減少は少なかった。
このように【痛みに対してネガティブな思考をポジティブに変えること】がVLPFC(腹外側前頭前野)を活性化させ、側坐核を賦活させることで、ドーパミン・オピオイドシステムを起動させ下行性疼痛抑制系の働きを高めることになるのです。
不安をなくすことによる鎮痛作用機序
『ある朝、出勤中の電車の中で降りようとして腰をあげた瞬間に「ギクッ!!」全く動けない。こんな激痛は初めての経験で頭はパニック。全く身動きできず、駅員に助けてもらいながら救急車で運ばれる。画像診断をすると「ヘルニアが神経をかなり圧迫している」と言われ「手術も検討したほうがいい」とショックを受ける。

その後も痛みは一向に変わらず数週間が経ち、ようやく動けるようになってからもまた立ち上がるときにあの激痛が起きるのではないかと怖くなり、腰をかばうような動きが多くなり、趣味であった運動も億劫になってしまった。睡眠も浅く、気分も落ち込みがちで仕事は重たい物を運ぶ仕事なので休職中』
このような状態の時、最優先の治療ターゲットはどこでしょうか?
たしかに腰からの侵害刺激が強いようであれば、直接アプローチをして痛みの軽減を目指すことも有効でしょうが、情動・認知的側面からみると、扁桃体の過剰興奮による「恐怖・不安」が大きいかと思います。
同時に側坐核の機能低下の可能性もあり、鎮痛のためのドーパミン・オピオイドシステムも不活性でしょう。
そのためにまずは、痛みの正しい知識を知り、「身体を動かすと痛くなる」という恐怖条件付けから「身体を動かしても痛くない」ということを少しずつ繰り返し経験し、さらに運動など身体を動かずことは「気持ちがいい」という「快情動」を報酬とすることで、扁桃体の過活動が治まり、側坐核が活性化することを期待したい。
このプロセスにおいて「動かすと痛い、怖い」という恐怖学習から、「動くことは気持ちい」という報酬学習に切り替えることが重要で、これがいわゆる「認知行動療法」と言えます。
そしてそのターゲットが1つが「内側前頭前野」なのです。
運動による鎮痛作用機序
日本でも今年3月に出た「慢性疼痛治療ガイドライン」では、「運動」と「認知行動療法」が慢性疼痛治療には有効と記されておりますが、いくら運動が有効だからと言っても、「好きな運動してくださいね」ではいけません。まず慢性疼痛でお困りの方は痛みが強い場合も多く、身体が自由に動かせないか動くにしても動作に対して「不安・恐怖」が強いでのです。
「慢性疼痛治療ガイドライン」
また慢性疼痛は扁桃体を過剰に興奮させ、相対的に側坐核の機能低下を招きますので、ドーパミンの分泌も減少し、下行性疼痛抑制系も弱まっている状態です。さらに内側前頭前野はGABAニューロンが過剰に興奮し、抑制の働きが強まる一方で、外側前頭前野は機能低下を起こし、認知・思考力も低下することでうつ傾向が高まります。
そのような状態ではポジティブ思考になれず、「痛みが気になってしまう」「だんだんと悪くなっている」「自分では何もできない」という『痛みの破局化思考』に陥っている可能性もあります。
そこでアプローチする順番は患者さんそれぞれ違うかとは思いますが、最終的なゴールとしては『側坐核を活性化させドーパミン・オピオイドシステムを機能させること』を目標に運動指導します。
「動かしたらまた痛くなる」と認知されている患者さんであれば、痛みのメカニズムを説明し、まずは「動ける範囲内で動かしてみる」その繰り返しで、「もしかしたら動かしても大丈夫かも?」から「動かせる」というポジティブな再解釈が行われます。その際に活性化されるのが外側前頭前野のvlPFCです。vlPFCの機能が活性化することで扁桃体の機能を抑えることになります。
また運動することで、痛みから注意が逸れ、自分で痛みをコントロールしている感じがつかめると(自己効力感)、外側前頭前野の働きも活性化し、トップダウンでPAGを活性化させ下行性疼痛抑制系を賦活します。
VTAにも興奮性の刺激を与えることや小さな目標を立て、目標を達成することで脳報酬系(mesolimbic system)を活性化させ側坐核の機能の回復を目指します。
また運動行為が「不安なもの」ではなく、「気持ちいいもの」、「楽しいもの」という認知に変われば、「快の情報」が扁桃体から側坐核へ入力され、側坐核の機能が高まります。
またCeA(中心核)への出力が弱まることで恐怖反応もなくなり、逆に内側前頭前野のスイッチングの働きにより、内側前頭前野から側坐核に興奮性の入力が入り鎮痛に繋がります。
さらに運動自体の刺激は背外側被蓋核(LDT)から興奮性の刺激が中脳腹側被蓋野(VTA)に入力され、ドーパミンが側坐核に分泌され、結果、ドーパミン・オピオイドシステムが活性化され鎮痛作用が生じます。
このように運動をすることは身体の側面だけでなく、痛みを抑える働きを高めるとともに、「脳報酬系」(mesolimbic system)を賦活することで、イキイキとした生きがいのある日々を過ごせるきっかけとなるのです。
a:1646 t:1 y:0